- May -akda Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:43.
- Huling binago 2025-01-23 12:50.
Ang pagbabanto ay ang proseso ng paggawa ng isang puro solusyon na mas maghalo. Mayroong iba't ibang mga kadahilanan kung bakit ang isang tao ay nais na gumawa ng isang pagbabanto, mula sa malubhang hanggang sa simpleng mga kadahilanan. Halimbawa, ang mga biochemist ay naghuhugas ng mga solusyon mula sa kanilang mga naka-concentrate na form upang makagawa ng mga bagong solusyon para magamit sa mga eksperimento, samantalang, sa kabilang banda, ang mga bartender ay madalas na nagpapalabnaw ng alak sa mga softdrinks o juice upang gawing mas masarap ang mga cocktail. Ang pangkalahatang pormula para sa pagkalkula ng dilution ay C1V1 = C2V2, kasama ang C1 at C2 kumakatawan sa pauna at panghuling konsentrasyon ng solusyon, ayon sa pagkakabanggit, at V1 at V2 kumakatawan sa lakas ng tunog.
Hakbang
Paraan 1 ng 2: Tumpak na Paghahalo ng Mga Concentrate sa pamamagitan ng Equation ng Dilution

Hakbang 1. Tukuyin kung ano ang alam at hindi alam
Ang dilution sa kimika ay karaniwang nangangahulugang pagkuha ng isang maliit na halaga ng isang solusyon kung saan alam mo ang konsentrasyon, pagkatapos ay pagdaragdag ng isang walang likidong likido (tulad ng tubig) upang makagawa ng isang bagong solusyon na may mas malaking dami ngunit mas mababang konsentrasyon. Ito ay madalas na ginagawa sa mga laboratoryo ng kimika, sapagkat, alang-alang sa pagiging epektibo, ang mga reagents ay madalas na nakaimbak sa napakataas na konsentrasyon, na pagkatapos ay lasaw para magamit sa mga eksperimento. Karaniwan, sa karamihan ng mga sitwasyon sa totoong mundo, malalaman mo ang konsentrasyon ng iyong paunang solusyon at ang konsentrasyon o dami na nais mong maging iyong huling konsentrasyon, ngunit hindi ang dami ng paunang solusyon na kailangan mo upang makuha ang pangwakas na solusyon.
- Gayunpaman, sa iba pang mga sitwasyon (lalo na sa mga problema sa paaralan), maaaring kailanganin mong maghanap ng iba pang mga piraso ng palaisipan - halimbawa, maaari kang bigyan ng paunang dami at konsentrasyon, pagkatapos ay hilingin na hanapin ang panghuling konsentrasyon kung palabnawin mo ang isang solusyon. sa nais na dami. Sa anumang kaso ng pagbabanto, kapaki-pakinabang na tandaan ang mga kilala at hindi kilalang variable bago magsimula.
-
Tapusin natin ang mga halimbawang katanungan. Ipagpalagay na hinilingan tayong maghalo ng isang 5 M na solusyon sa tubig upang makagawa ng 1 L ng isang 1. solusyon mM. Sa kasong ito, alam namin ang konsentrasyon ng aming paunang solusyon at ang dami at huling konsentrasyon na gusto namin, ngunit hindi ang dami ng paunang solusyon na kailangan namin upang idagdag sa tubig upang makamit ang nais na resulta.
Paalala: Sa kimika, ang M ay isang pagsukat ng konsentrasyon na tinatawag na Molarity, na nagsasaad ng mga moles ng isang sangkap bawat litro
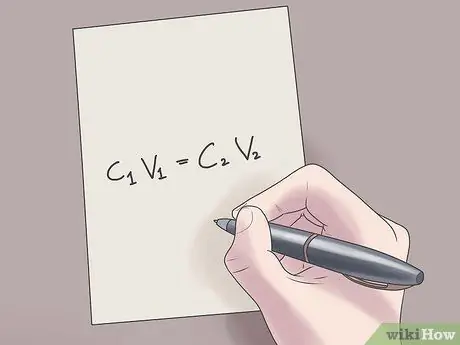
Hakbang 2. I-plug ang iyong mga halaga sa pormula C1V1 = C2V2.
Sa pormulang ito, C1 ay ang paunang konsentrasyon ng solusyon, V1 ay ang dami ng paunang solusyon, C2 ay ang pangwakas na konsentrasyon ng solusyon, at V2 ay ang dami ng pangwakas na solusyon. Ang pag-plug ng mga kilalang halaga sa equation na ito ay makakatulong sa iyo na makahanap ng mga hindi kilalang halaga na may mas kaunting kahirapan.
- Maaari mong makita na kapaki-pakinabang na maglagay ng isang tandang pananong sa harap ng yunit na nais mong hanapin upang matulungan kang malutas ito.
-
Ituloy natin ang ating halimbawa. Ipapasok namin ang mga halagang alam namin tulad ng sumusunod:
- C1V1 = C2V2
- (5 M) V1 = (1 mM) (1 L). Ang aming dalawang konsentrasyon ay may magkakaibang mga yunit. Huminto tayo dito at magpatuloy sa susunod na hakbang.

Hakbang 3. Isaalang-alang ang anumang mga pagkakaiba sa yunit
Dahil ang mga solusyon ay nagsasangkot ng mga pagbabago sa konsentrasyon (na kung minsan ay maaaring malaki), hindi karaniwan para sa dalawang variable sa iyong equation na magkaroon ng magkakaibang mga yunit. Habang madali itong hindi pansinin, ang hindi pantay na mga yunit sa iyong equation ay maaaring maging sanhi ng iyong sagot na hindi tama. Bago matapos, i-convert ang lahat ng mga halaga na may iba't ibang mga konsentrasyon at / o dami ng mga yunit.
-
Sa aming halimbawa, gumagamit kami ng iba't ibang mga yunit para sa mga konsentrasyon ng M (molars) at mM (millimolars). Baguhin natin ang ating pangalawang pagsukat sa M:
- 1 mM × 1 M / 1,000 mM
- = 0.001 M

Hakbang 4. Tapusin
Kapag ang lahat ng mga yunit ay pantay, malutas ang iyong equation. Ito ay halos palaging magagawa sa simpleng algebra.
-
Pinahinto namin ang aming halimbawa ng problema dito: (5 M) V1 = (1 mM) (1 L). Hanapin natin ang halaga ng V1 kasama ang aming bagong yunit.
- (5 M) V1 = (0.001 M) (1 L)
- V1 = (0.001 M) (1 L) / (5 M).
-
V1 = 0,0002 L, o 0.2 mL.

Hakbang 5. Maunawaan kung paano gamitin nang tama ang iyong sagot
Sabihin nating natagpuan mo ang iyong nawawalang halaga, ngunit hindi ka sigurado kung paano gamitin ang bagong impormasyon sa aktwal na pagbabanto na kailangan mong gawin. Ito ay naiintindihan - ang wika ng matematika at agham kung minsan ay hindi tumutugma sa totoong mundo. Kapag alam mo ang apat na halagang nasa equation C1V1 = C2V2, gawin ang pagbabanto tulad ng sumusunod:
- Sukatin ang dami V1 mula sa isang solusyon na may konsentrasyon ng C1. Pagkatapos, magdagdag ng sapat na diluent (tubig, atbp.) Upang gawin ang kabuuang dami ng V2. Ang bagong solusyon na ito ay magkakaroon ng konsentrasyong nais mo (C2).
- Sa aming halimbawa, halimbawa, sinusukat muna namin ang 0.2 ML ng isang solusyon na 5 M. Susunod, magdaragdag kami ng sapat na tubig upang madagdagan ang dami ng solusyon sa 1 L: 1 L - 0,0002 L = 0.9998 L, o 999, 8 mL. Sa madaling salita, magdaragdag kami ng 999.8 ML ng tubig sa aming maliit na sample na solusyon. Ang aming bago, lasaw na solusyon ay may konsentrasyon na 1 mM, na siyang nais naming konsentrasyon.
Paraan 2 ng 2: Paggawa ng isang Simple at Praktikal na Solusyon sa Paghahalo

Hakbang 1. Basahin ang anumang packaging para sa impormasyon
Mayroong iba't ibang mga kadahilanan kung bakit maaaring nais mong gumawa ng isang solusyon ng pagbabanto sa bahay, sa kusina, o sa ibang laboratoryo na hindi kemikal. Halimbawa, ang paggawa ng orange juice mula sa isang simpleng pagtuon ay isang pagbabanto. Sa maraming mga kaso, ang produktong kailangang lasawin ay naglalaman ng impormasyon tungkol sa pagbabanto na kailangang gawin, saanman sa binalot. Maaari silang magkaroon ng tumpak na mga tagubiling susundan. Narito ang ilang mga bagay na hahanapin para sa paghahanap ng impormasyon:
- Dami ng ginamit na produkto
- Dami ng ginamit na diluent
- Uri ng diluent na ginamit (karaniwang tubig)
- Espesyal na mga tagubilin sa paghahalo
- Maaaring hindi mo makita ang impormasyon tungkol sa eksaktong konsentrasyon ng likidong ginamit. Ang impormasyong ito ay hindi kapaki-pakinabang sa average na consumer.

Hakbang 2. Idagdag ang sangkap na gumaganap bilang isang diluent sa puro solusyon
Para sa mga simpleng dilutions ng sambahayan, tulad ng mga maaaring gawin sa kusina, kailangan mo lamang malaman ang dami ng konsentrasyon na iyong ginagamit at ang tinatayang huling konsentrasyon na gusto mo bago ka magsimula. Haluin ang concentrate sa isang naaangkop na halaga ng diluent, na natutukoy depende sa dami ng ginamit na paunang concentrate. Tingnan sa ibaba:
- Halimbawa, kung nais naming palabnawin ang 1 tasa ng orange juice na tumutok sa 1/4 sa paunang konsentrasyon nito, idaragdag namin 3 tasa tubig sa concentrate. Ang aming huling halo ay magkakaroon ng 1 tasa ng pagtuon sa 4 na tasa ng buong likido - 1/4 ng paunang konsentrasyon.
- Narito ang isang mas kumplikadong halimbawa: Kung nais naming palabnawin ang 2/3 tasa ng pagtuon sa 1/4 ang paunang konsentrasyon, magdagdag kami ng 2 tasa ng tubig, dahil ang 2/3 tasa ay katumbas ng 1/4 beses 2 & 2/3 tasa ng buong likido.
- Siguraduhing idagdag ang iyong sangkap sa isang lalagyan na sapat na malaki upang hawakan ang pangwakas na dami ng gusto mo - isang malaking mangkok o katulad na lalagyan.

Hakbang 3. Huwag pansinin ang dami ng pulbos sa karamihan ng mga kaso
Ang pagdaragdag ng isang pulbos (tulad ng ilang mga mix ng inumin) sa isang likido ay karaniwang hindi isinasaalang-alang isang pagbabanto. Ang pagbabago ng lakas ng tunog na nagreresulta mula sa pagdaragdag ng isang maliit na halaga ng pulbos sa likido ay karaniwang sapat na maliit upang maging bale-wala. Sa madaling salita, kapag nagdaragdag ng isang maliit na halaga ng pulbos sa isang likido, idagdag lamang ang pulbos sa iyong nais na pangwakas na dami ng likido at ihalo.
Babala
- Sundin ang anumang mga alituntunin sa kaligtasan na ibinigay ng gumawa o kinakailangan ng iyong kumpanya. Ito ay lalong mahalaga kung kailangan mong palabnawin ang solusyon sa acid.
- Ang pagtatrabaho sa mga acidic na solusyon ay maaaring mangailangan ng mas detalyadong mga hakbang sa kaligtasan at alituntunin kaysa sa mga solusyon na hindi acidic.






