- May -akda Jason Gerald gerald@how-what-advice.com.
- Public 2023-12-16 11:43.
- Huling binago 2025-01-23 12:50.
Kung nakita mong nakalilito at mahirap maunawaan ang periodic table, huwag magalala, hindi ka nag-iisa! Ang pag-unawa sa kung paano gumagana ang pana-panahong talahanayan ay maaaring maging mahirap, ngunit sa pamamagitan ng pag-aaral kung paano basahin ito, ikaw ay matagumpay sa agham. Magsimula sa pamamagitan ng pag-unawa sa istraktura sa periodic table at ang impormasyong ipinapakita nito tungkol sa mga elemento. Susunod, maaari mong pag-aralan ang bawat isa sa mga elemento. Panghuli, gamitin ang impormasyong nakalista sa periodic table upang malaman ang bilang ng mga neutron sa isang atom.
Hakbang
Bahagi 1 ng 3: Pag-unawa sa Istraktura ng Periodic Table
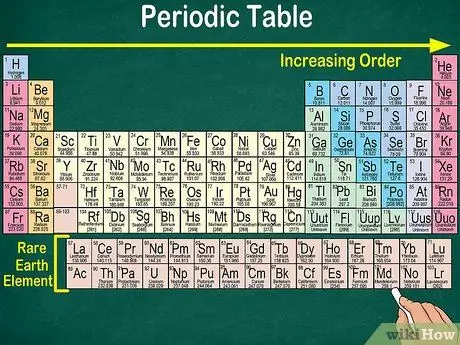
Hakbang 1. Basahin ang periodic table mula sa kaliwa sa itaas hanggang sa kanang ibaba
Ang mga elemento ay nakaayos ayon sa kanilang bilang ng atom. Ang karagdagang sa kanan at pababa, mas mataas ang bilang ng atomic. Ang bilang ng atomiko ay ang bilang ng mga proton na mayroon ang atom ng isang elemento. Sa iyong pagpunta sa kanan, mapapansin mo rin na dumarami ang bilang ng masa ng bawat atom. Iyon ay, maaari mong maunawaan ang bigat ng isang elemento kahit na sa pamamagitan lamang ng pagtingin sa lokasyon nito sa mesa.
- Ang karagdagang sa kanan o pababa, ang atomic mass ng elemento ay tataas dahil ang atomic mass ay kinakalkula sa pamamagitan ng pagdaragdag ng mga proton at neutron sa bawat atom ng elemento. Ang bilang ng mga proton ay tataas sa elemento, na nangangahulugang tumataas din ang bigat nito.
- Ang electron ay hindi kasama sa atomic mass dahil kung ihahambing sa proton at neutron, ang mga electron ay walang gaanong epekto sa bigat ng atomic.

Hakbang 2. Maunawaan na ang bawat elemento ay naglalaman ng 1 higit pang proton kaysa sa atom sa kaliwa nito
Maaari mong sabihin ito sa pamamagitan ng pagtingin sa numero ng atomic. Ang mga numero ng atomiko ay nakaayos mula kaliwa hanggang kanan. Ang mga elemento ay pinaghiwalay din sa 3 mga pangkat, maaari mong makita ang pagpapangkat sa talahanayan.
Halimbawa, ang unang hilera ay naglilista ng hydrogen, na mayroong atomic number 1, at helium, na mayroong atomic number 2. Gayunpaman, ang dalawang elemento na ito ay matatagpuan sa dulong kaliwa at kanan ng talahanayan sapagkat sila ay nasa magkakaibang mga grupo
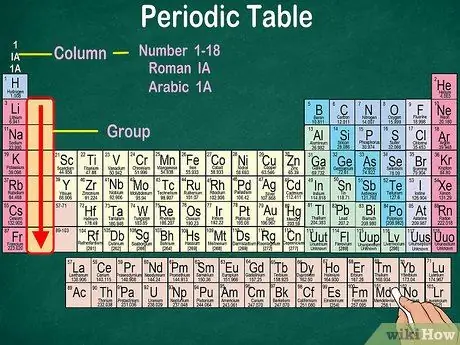
Hakbang 3. Kilalanin ang mga pangkat ng mga atomo, na may parehong katangiang pisikal at kemikal
Ang mga pangkat ay ipinahiwatig ng mga patayong haligi. Sa karamihan ng mga kaso, ang mga pangkat ay nailalarawan sa pamamagitan ng parehong kulay. Matutulungan ka nitong makilala kung aling mga elemento ang may katulad na katangiang pisikal at kemikal. Gagawin nitong mas madali para sa iyo na mahulaan ang mga reaksyon ng mga elementong ito. Ang bawat elemento sa isang naibigay na pangkat ay may parehong bilang ng mga electron sa kanyang pinakamalabas na orbital.
- Karamihan sa mga elemento ay nabibilang lamang sa isang pangkat. Gayunpaman, ang hydrogen ay maaaring maiuri bilang alinman sa isang halogen o isang alkali metal. Sa ilang mga talahanayan, lumilitaw ang hydrogen sa parehong mga grupo.
- Sa karamihan ng mga kaso, ang mga haligi ay mabibilang ng 1-18, alinman sa tuktok o ibaba ng talahanayan. Ang mga numero ay maaaring ipakita sa roman numerals (IA), mga arabic number (1A), o mga numero (1).
- Basahin ang mga pangkat ng atom mula sa itaas hanggang sa ibaba.
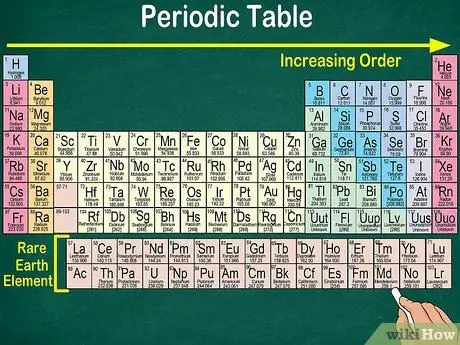
Hakbang 4. Pansinin ang blangkong puwang sa talahanayan
Bilang karagdagan sa bilang ng atomiko, ang pagsasaayos ng mga elemento sa mga pangkat at pangkat ay isinasaalang-alang din ang parehong mga katangiang pisikal at kemikal. Sa ganitong paraan, mas mauunawaan mo kung ano ang reaksyon ng bawat elemento. Ang pagdaragdag ng mga elemento ng kemikal ay ginagawang mas mahirap ang kanilang pag-uuri, kaya't hindi nakakagulat na ang panaka-nakang mesa ay naglalaman ng walang laman na puwang.
- Halimbawa, ang unang 3 mga hilera ay may mga blangko na puwang, dahil ang mga paglipat ng metal na lilitaw sa talahanayan ay mga elemento na may atomic number 21.
- Katulad nito, ang mga elemento na 57 hanggang 71, na kung saan ay mga bihirang elemento ng lupa o bihirang mga elemento ng lupa, ay hiwalay na inilalarawan sa ibabang kanang bahagi ng talahanayan.
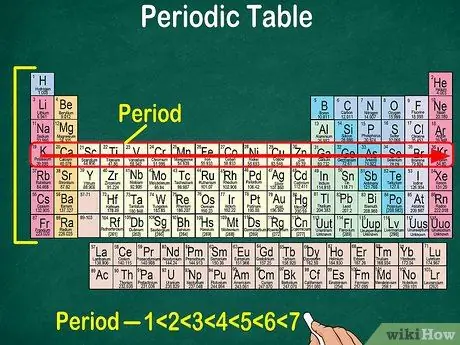
Hakbang 5. Pansinin na ang bawat hilera ay tinatawag na isang panahon
Ang lahat ng mga elemento sa isang panahon ay may parehong bilang ng mga atomic orbital, kung saan dumadaan ang mga electron. Ang bilang ng mga orbital ay tumutugma sa bilang ng mga panahon. Ang periodic table ay nagpapakita ng 7 mga hilera, na nangangahulugang mayroong 7 mga panahon.
- Halimbawa, ang isang elemento sa panahon ng 1 ay may 1 orbital, habang ang isang elemento sa panahon 7 ay may 7 orbital.
- Sa karamihan ng mga kaso, ang mga panahon ay may bilang na 1-7 mula sa itaas hanggang sa ibaba sa kaliwang bahagi ng talahanayan.
- Basahin ang panahon ng mga elemento ng pagsunod sa hilera mula kaliwa hanggang kanan.
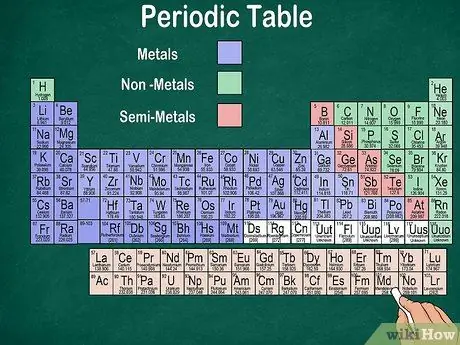
Hakbang 6. Pagkilala sa pagitan ng mga metal, semimetal at nonmetal
Mas mahusay mong maunawaan ang mga katangian ng mga elemento sa pamamagitan ng pagkilala sa uri ng elemento. Sa kasamaang palad, ang karamihan sa pana-panahong talahanayan ay gumagamit ng kulay upang ipahiwatig kung ang isang elemento ay isang metal, isang semimetal, o isang nonmetal. Makakakita ka ng mga elemento ng metal sa kanan ng mesa, habang ang mga hindi metal sa kaliwa. Ang pangkat ng semi-metal ay matatagpuan sa pagitan ng mga metal at di-metal.
- Tandaan na ang hydrogen ay maaaring mapangkat sa mga halogens o sa alkali na metal dahil sa mga katangian nito. Samakatuwid, natural para sa hydrogen na lumitaw sa magkabilang panig ng mesa o maging ibang kulay.
- Ang isang elemento ay tinatawag na metal kung ito ay makintab, solid sa temperatura ng kuwarto, nagsasagawa ng init at kuryente, at malambot at nababanat.
- Ang isang elemento ay itinuturing na isang nonmetal kung hindi ito makintab, hindi nagsasagawa ng init o kuryente, at mahirap. Ang mga elementong ito ay karaniwang gas sa temperatura ng kuwarto, ngunit maaari ding maging solid o likido sa ilang mga temperatura.
- Ang isang elemento ay tinatawag na isang semimetal kung mayroon itong pinagsamang mga katangian ng isang metal at isang hindi metal.
Bahagi 2 ng 3: Pag-aaral ng Mga Sangkap
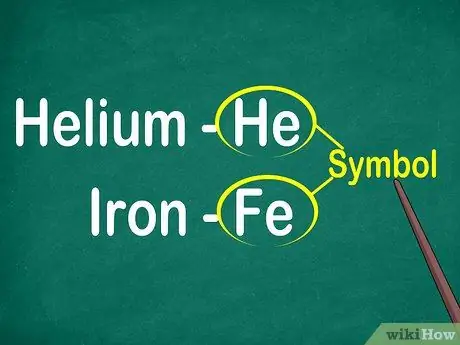
Hakbang 1. Kilalanin ang mga simbolo ng elemento ng 1 hanggang 2 titik
Ang simbolo ay karaniwang matatagpuan sa gitna ng isang parisukat na may isang malaking font. Ang mga simbolo ay pagpapaikli para sa mga pangalan ng elemento, na na-standardize sa iba't ibang mga wika. Kapag gumagawa ng mga eksperimento o nagtatrabaho sa mga elemental na equation, marahil ay gagamit ka ng mga simbolo ng elemento. Samakatuwid, gusto mo o hindi, kailangan mong pamilyar ang iyong sarili sa mga simbolo ng elemental.
Ang mga simbolo ay karaniwang nagmula sa Latin na pangalan ng elemento, ngunit kung minsan ay nagmula sa mga pangalan na malawakang ginagamit, lalo na ang mga bagong elemento. Halimbawa, ang simbolo para sa Helium ay He, na nangangahulugang kilalang pangalan na ito. Gayunpaman, ang simbolo para sa bakal ay Fe, na medyo mahirap makita sa unang tingin

Hakbang 2. Hanapin ang buong pangalan ng elemento, kung mayroon man
Ito ang pangalan ng sangkap na gagamitin mo kung kailangan mong isulat ito nang buo. Halimbawa, ang "Helium" at "Carbon" ay ang mga pangalan ng mga elemento. Sa karamihan ng mga kaso, ang pangalan ng elemento ay nasa ibaba ng simbolo, ngunit maaaring magkakaiba ang pagkakalagay.
Ang ilang mga pana-panahong talahanayan ay maaaring hindi isama ang buong pangalan at gumagamit lamang ng mga simbolo
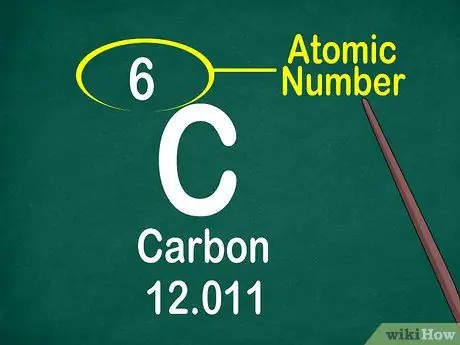
Hakbang 3. Tandaan ang numero ng atomic
Ang numero ng atomiko ay karaniwang matatagpuan sa tuktok ng kahon, alinman sa gitna o sa sulok ng kahon. Gayunpaman, ang numero ng atomic ay maaari ding matatagpuan sa ilalim ng simbolo ng elemento o pangalan ng elemento. Ang mga numero ng atomic ay iniutos mula 1-118.
Ang bilang ng atomiko ay isang integer, hindi isang decimal
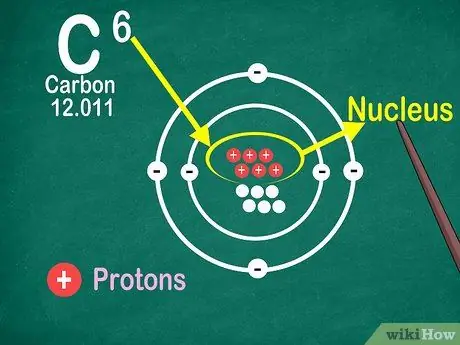
Hakbang 4. Malaman na ang bilang ng atomiko ay ang bilang ng mga proton sa atom
Ang lahat ng mga atom sa isang elemento ay may parehong bilang ng mga proton. Hindi tulad ng mga electron, ang mga proton ay hindi maaaring makuha o mailabas ng mga atom. Magbabago ang mga elemento kung ang mga atom ay maaaring mahuli o mawala ang mga atom.
Kailangan mo rin ang numero ng atomic upang malaman ang bilang ng mga electron at neutron
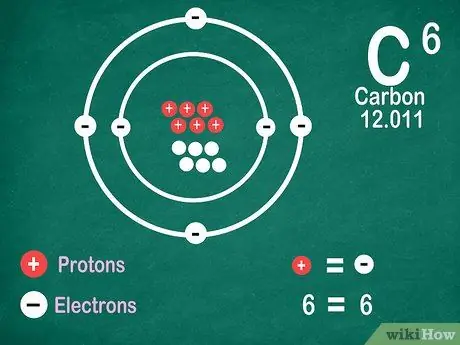
Hakbang 5. Alamin na ang mga elemento ay naglalaman ng parehong bilang ng mga electron bilang mga proton, maliban kung ang elemento ay sumasailalim sa ionization
Ang mga proton ay may positibong singil, habang ang mga electron ay may negatibong singil. Dahil ang isang walang kinikilingan na atom ay walang singil sa kuryente, nangangahulugan ito na mayroon itong parehong bilang ng mga electron at proton. Gayunpaman, ang mga atomo ay maaaring mawala at makakuha ng mga electron, na ginagawang ionized.
- Ang mga ion ay singil sa kuryente. Kung maraming mga proton sa isang ion, positibo ang singil, na isang positibong (+) pag-sign sa tabi ng simbolo ng ion. Kung ang bilang ng mga electron sa ion ay higit pa, ang singil ay negatibo, na kung saan ay negatibo (-).
- Hindi ka makakakita ng isang positibo o negatibong pag-sign kung ang isang atom ay hindi isang ion.
Bahagi 3 ng 3: Paggamit ng Timbang ng Atom upang Bilangin ang mga Neutron

Hakbang 1. Alamin ang bigat ng atomic
Ang bigat ng atomic ay karaniwang matatagpuan sa ilalim ng kahon, sa ibaba ng simbolo ng elemento. Ang bigat ng atom ay ang pinagsamang bigat ng mga maliit na butil sa atomic nucleus, kabilang ang mga proton at neutron. Gayunpaman, maaaring kumplikado ng mga ions ang proseso ng pagbibilang. Kaya, ang bigat ng atomic ay nagpapahiwatig ng average na atomic mass ng elemento at ang atomic mass ng mga ions nito.
- Dahil sa kanilang average na timbang, karamihan sa mga atomo ay may mga timbang na atomic sa decimal form.
- Bagaman ang bigat ng isang elemento ay nagmumukhang kung tumataas ito mula kaliwa hanggang kanan, hindi palaging iyon ang kaso.
Hakbang 2. Tukuyin ang bilang ng masa ng elemento na iyong pinag-aaralan
Maaari mong mahanap ang numero ng masa sa pamamagitan ng pag-ikot ng atomic mass. Ang katotohanang ito ay nagpatunay na ang timbang ng atomiko ay ang average ng lahat ng mga atomic na masa, kabilang ang mga ions.
Halimbawa, ang bigat ng atomic ng carbon ay 12,011 kaya't bilugan ito hanggang sa 12. Gayundin, ang bigat ng atomic ng iron ay 55.847 kaya't bilugan ito hanggang sa 56
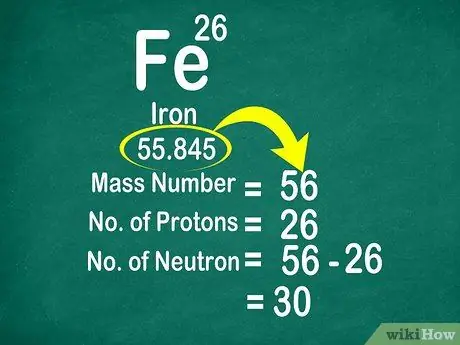
Hakbang 3. Ibawas ang numero ng masa mula sa atomic number upang mabilang ang mga neutron
Ang bilang ng masa ay maaaring kalkulahin sa pamamagitan ng pagdaragdag ng bilang ng mga proton sa bilang ng mga neutron. Gagawin nitong mas madali para sa iyo na kalkulahin ang bilang ng mga neutron sa isang atom, sa pamamagitan ng pagbawas ng bilang ng masa mula sa bilang ng mga proton
- Gamitin ang formula na ito: Neutron = Mass Number - Proton
- Halimbawa, ang dami ng masa ng Carbon ay 12 at mayroong 6 na proton. Sa gayon, malalaman natin na ang Carbon ay mayroong 6 na neutron dahil 12 - 6 = 6.
- Isa pang halimbawa, ang dami ng iron na 56 at may 26 proton. Kaya, alam natin na ang iron ay mayroong 30 neutrons dahil 56 - 26 = 30.
- Naglalaman ang mga isotopes ng atoms ng iba't ibang bilang ng mga neutron kaya't nagbabago ang kanilang mga timbang na atomiko.
Mga Tip
- Ang pagbabasa ng periodic table ay mahirap para sa ilang mga tao. Huwag panghinaan ng loob kung nahihirapan kang pag-aralan ang pana-panahong talahanayan!
- Ang mga kulay sa talahanayan ay maaaring magkakaiba, ngunit ang nilalaman ay mananatiling pareho.
- Ang ilang mga pana-panahong talahanayan ay maaaring magbigay ng hindi kumpletong impormasyon. Halimbawa, ang ilang mga talahanayan ay nagbibigay lamang ng simbolo at numero ng atomic. Para doon, maghanap ng isang talahanayan na nababagay sa iyong mga pangangailangan!






